실크 단백질을 이용한 친환경 나노 소재 물성 분석: 분자동역학 및 탄성네트워크 모델을 이용한 연구
© The Korean Society for Noise and Vibration Engineering
Abstract
The demand for silk peptide-based nanomaterials have been increasing owing to their excellent mechanical properties. However, analyzing the nanostructure and mechanical properties of new silk peptide-based materials remains a challenge. In this study, we examined silkworm silk peptide, a biocompatible and eco-friendly material, as a next-generation nanomaterial. The secondary structure of the silk peptide-based nanomaterial was analyzed. The results demonstrated that the content of the beta-sheet and hydrogen bonding significantly affected the mechanical properties, and the (GAGAGS) motif and (GAGAGY) motif forming the beta-sheet were the role of the motif. Additionally, elastic network modeling (ENM) was performed to approximate the mechanical properties of the silk peptide-based nanomaterial. Our results showed the output of 13.795 GPa on average for each mode shape. Furthermore, vdW and hydrophobic interactions were shown to be the reason for these excellent mechanical properties. Moreover, we gained important insight on the design of next-generation silk peptide-based nanomaterials. Our study serves as a good reference point for elucidating the structural stability and mechanical properties of silk peptide-based nanomaterials and applying them as next-generation nanomaterials in various research fields.
Keywords:
Silk-peptide, Beta-sheet, Molecular Dynamics, Elastic-network Model키워드:
실크 펩타이드, 베타 시트, 분자동역학, 탄성 네트워크 모델1. 서 론
실크는 친환경 및 생체 적합성과 우수한 물성을 가진 재료로서 차세대 신소재 후보로 많은 연구가 진행되고 있다. 누에 실크 단백질은 2개의 자가 응집된 세리신과 피브로인으로 구성되며, 전자는 후자 주위에 감싸져 형성되어 있다. 실크의 피브로인 단백질은 고강도 철(1.5 GPa)보다도 인장강도가 높고, 하이드로젤, 필름, 매트 등 여러 형태로 재구성될 수 있어(1) 넓은 범위의 어플리케이션에 기반 재료로 사용될 수 있다(2). 이러한 장점으로, 지난 수십 년 동안 누에 실크의 기계적 특성과 미세 구조와의 의존성 관계에 대해 많은 연구가 진행되고 있다(3~4). 특히, 자연 누에 실크는 인공 누에 실크보다 강도가 더 강하다는 실험 연구가 진행되었고(5), 여러 환경 조건에서 누에 실크에 대한 기계적 물성 연구도 많이 진행되었다(6). 이러한 기존 연구를 바탕으로 누에 실크 단백질을 이용하여 광학(7), 의료(8,9), 전자 장비(10) 등 여러 분야에서 많이 활용되고 있다. 또한, 실크 단백질 기반 UV(Ultraviolet) PR 소재에 대한 가능성을 연구한 사례가 있고(11), 또한 Greenwood 등에 따르면(12), Phenylalanine 아미노산이 EUV 광에 노출되면 Auger process에 의거하여 Cα-Cβ 본드가 분리되는 것을 확인하였다.
Phenylalanine 아미노산은 실크 단백질를 구성하는 Tyrosine과 같은 소수성 측쇄(side chain)을 가지는 아미노산으로서, 위의 연구 성과는 실크 단백질 기반 나노 소재가 광 반응성을 가지며, 이는 전자 및 광학 분야에도 활용성이 많다는 것을 알 수 있다. 이렇게 많은 기존 연구를 통해서 누에 실크 단백질에 대한 기계적 물성 분석 연구가 이루어져 왔지만 누에 실크 자체적으로 구조적 안정성 및 기계적 물성과의 관계에 대한 특성화 및 요소 분석에 대해서는 아직 연구가 많이 부족하다. 실크 단백질의 베타 시트(beta-sheet)는 구조적으로 매우 안정하며(13), 기계적 물성에 영향을 미치는 것으로 알려져 있다. 하지만, 이론적 관점에서 베타 시트에 대한 구조적 안정성 및 중요 인자 분석에 대한 방법론이 아직 이루어지지 않고 있다. 또한, 베타 시트 형성 및 기계적 물성에 대한 역학적 변수에 대한 기존 연구가 필요하다. 따라서, 분자동역학 시뮬레이션을 통해 실크 단백질의 베타 시트에 대한 구조적 안정성을 분석하고 탄성 네트워크 모델(Elastic Network Model, ENM)을 이용하여 기계적 물성을 평가하였다. 이를 통해 실크 단백질 기반 나노 소재에 대한 특성화를 확인하고, 이를 통해 실크 단백질 기반 소재를 설계하는데 있어서 설계 전략을 제시한다.
2. 재료 및 방법
2.1 분자 모델링: 베타 시트
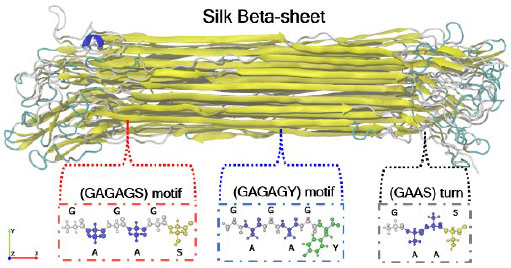
실크 펩타이드 모델은 bombyx mori silkworm 실크 서열 기반으로 구성하였다. Bombyx mori silkworm 실크는 비결정질(TGSSGFGPYVANGGYSGYEYAWSSESDFGT)구조와 결정질(GAGAGSGAGAGYGAGAGSGAAS)구조로 이루어져 있다. 특히, 결정질은 베타 시트 및 턴(turn)과 코일(coil)형태의 2차구조로 이루어져 있고, 특히 베타 시트는 실크의 구조 및 물성에 중요한 영향을 미치는 것으로 알려져 있으며 베타 시트의 비율에 따라 기계적 물성이 달라지는 것으로 보고된다(14). 그리고 베타 시트를 구성하는 실크 가닥(strand)은 서로 역 평형(anti-parallel)로 구성되며 크기는 21 nm × 6 nm × 2 nm인 것으로 보고된다(13). 이 연구에서는 베타 시트 결정질을 UCSF Chimera를 통해 실크 펩타이드 모델을 모사하였다.
2.2 분자 동역학 시뮬레이션
모든 시뮬레이션에 앞서 에너지 최소화를 진행하였다. 이때 조건은 허용 오차 값이 1.0 kJ/mol이고 단계가 0.002 nm인 최대 1 000 000단계가 사용되었다. 전체 분자동역학 시뮬레이션은 Amber99SB-ildn force-field(15)와 함께 GROMACS 5.0.7을 사용하여 수행되었으며, xyz 방향의 주기적 경계 조건(PBC)에서 0.002 ps의 시간 간격으로 leap-frog 적분 알고리즘을 적용하였다. PBC box 유형은 계산 효율성을 최대화하기 위해 직사각형 모양으로 설정하였고, 시뮬레이션은 200 ns 동안 지속되었으며 열적 커플링(thermal coupling)의 온도 및 시간은 300 K 및 0.1 ps로 설정하였다. 압력 조건은 Parrinello-Rahman barostat으로 설정하였으며, 기준 압력은 1 bar 및 시간 상수는 2ps로 설정하였다(16,17).
2.3 탄성 네트워크 모델
실크의 기계적 물성을 평가하기 위해 ENM을 적용하였다. ENM이론은 원자가 가지고 있는 고유의 위치에너지에 근거하고, 원자간 위치 에너지가 평형하다고 가정하며, 가정된 모델은 매우 안정적이라고 가정한다. 이 때의 ENM의 전체 위치 에너지는 다음과 같이 표현할 수 있다.
| (1) |
여기서, N은 Cα 원자의 총 개수, h는 헤비사이드(heaviside) 함수를 나타내며 ΔRi 및 ΔRj 각각 위치 Ri 및 Rj에서 ith번째 및 jth번째 측쇄의 변위이다. 기호 rC는 원자 간 결합 여부를 판단하는 차단 거리(cut-off distance)로, 1.2 nm의 값일 때 그에 해당하는 힘 상수 γ는 7.113 kJ/mol이다. 추가적으로, 실크 기반 나노 소재 내 원자 간 발생하는 힘 장의 종류를 세분화하여 원자 간 비공유 결합(수소 결합)일 경우 10배(18)와 공유 결합일 경우 100배(19)의 힘 상수 값을 부여하였다. 공유결합은 실크 단백질 서열 상 i번째 원자에 대해 i-1th와 i+1th 원자 사이에 적용하였고, 수소결합의 경우 분자동역학 시뮬레이션 궤적 클러스터 중 대표 클러스터 평균 구조의 수소 결합 형태를 기준으로 선정하였다.
ENM의 위치 에너지는 행렬 표기법으로 식 (1)과 같이 표현할 수 있다.
| (2) |
여기서, ∆R은 ENM의 3N 차원 벡터이고 H는 3N × 3N 크기의 Hessian 행렬로 ENM의 강성을 표현한다. ENM에서 모드 해석(normal model analysis, NMA)을 수행하면 6가지 강체 모드를 제외한 저주파 범위 내에서 비강체 운동과 고유 진동수를 얻을 수 있다. 이러한 모드 내에서 굽힘(bending), 인장(axial), 비틀림(torsional)과 변형(deformation) 모드는 등가 연속체 탄성 구조의 인장 및 비틀림 탄성 계수를 계산하기 위해 선택되었다.
2.4 고유 모드 해석
연속체 역학에서 오일러-베르누이 빔 모델(euler-bernoulli beam model)에 의해서 굽힘, 비틀림 및 축강성에 대한 운동방정식을 정리하면, 연속체 탄성 구조의 인장 및 비틀림 탄성 계수는 고유 진동수를 사용하여 다음과 같이 표현할 수 있다(20~21).
| (3) |
| (4) |
| (5) |
여기서 EB, GB, 그리고 YT는 각각 실크 단백질에 대한 굽힘 강성, 비틀림 전단 계수 및 축 탄성 계수이고, ωB, ωA, 그리고 ωT는 각각 굽힘, 비틀림, 축 탄성 변형에 대한 해당 고유 진동수이다. 기호 ρ는 구조의 질량 밀도를 나타내고, L은 특성 길이이며, A는 단면적, βn는 모드 형상에 대한 종속 상수이다. 굽힘, 비틀림 및 축강성 모드에 해당하는 고유 진동수와 각각의 굽힘, 비틀림 및 축 강성 계수와 같은 기계적 특성은 변형 모드에 대한 고유 진동수와 관련하여 식 (3~5)와 같이 나타낼 수 있다. 특히 굽힘 모드에 대해서는 실크의 방향인 X축을 제외한 Y축 및 Z축에서의 굽힘을 고려하여 각각의 단면 계수를 고려하여 해당 모드 및 영률를 계산하였다. 여기서 π는 원의 둘레에 대한 지름의 비율이다.
2.5 계산 방법을 위한 데이터 분석
대표적인 구조를 추출하기 위해 GROMACS의 gmx_cluster plugin을 사용하여 Jarvis-Patrick 클러스터 분석을 수행하였고, 가장 큰 클러스터를 대표 모델로 사용하였다. 클러스터는 분자동역학 시뮬레이션에 대한 결과 프레임이 도출되는데, 이때 프레임에 따라 실크 단백질의 구조적 유사성을 기준으로 같은 프레임으로 간주한 것을 의미한다. 데이터는 RMSD(root-mean-square deviation), 2차 구조 분포 분석을 통해 베타 시트의 구조를 추출하고 이를 이용하여 구조 및 안정성을 분석하였다. 이때 2차 구조 분포는 VMD(visual moelcular dynamcis) 1.9.3. 타임라인 콘솔을 사용하여 궤적 구조에서 계산하였다.
2.6 에너지 계산 분석
Bombyx mori 실크의 결정질에 대해서 소수성 상호작용 및 반데르발스(Van der Waals) 상호작용에 대한 에너지를 계산하기 위해 GROMACS의 gmx_mmpbsa plugin을 사용하여 에너지 계산을 수행하였다(22). 분석에 사용된 모델을 2.5절의 대표 클러스터 모델을 선택하였고, 이에 대해 분자 기계적(molecular mechanics, MM)에너지, polar/non-polar 에너지, 그리고 반데르발스 및 정전기적(electrostatics) 에너지를 계산하였다. 위의 모든 에너지의 총합은 결합(binding) 에너지이며, 결합 에너지가 낮아질수록 더 강하게 결합한다는 것을 의미한다. 분자 기계적 에너지는 분자 모델에 대한 본드(bond), 각도(angle), 이면체(dihedral)에 대한 결합 에너지를 의미하며, polar 및 non-polar에너지는 Poisson-Boltzmann 방정식에 의거하여 물 분자와의 상호작용을 고려하여 에너지를 계산한다(23).
3. 결과 및 토론
3.1 실크 단백질 기반 나노 소재 분석
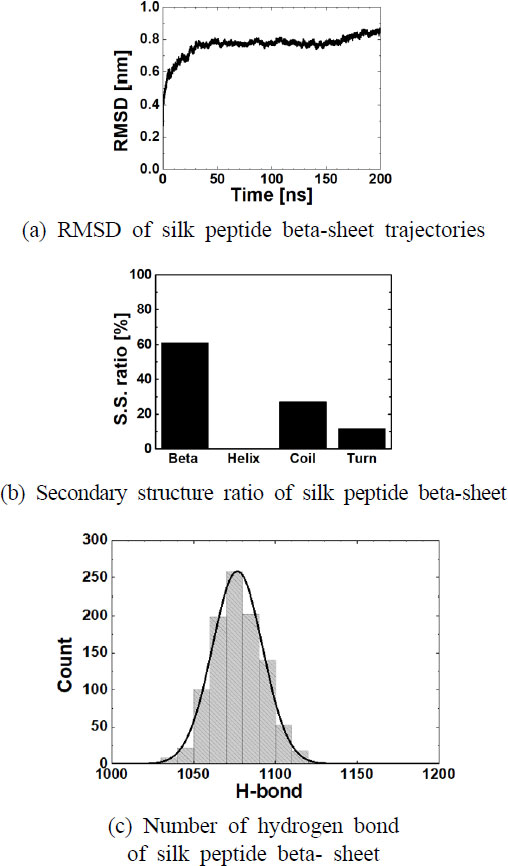
실크 단백질의 결정질에 대하여 분자 동역학 기반 평형 시뮬레이션을 수행하였다. 결정질 모델 중에서 베타 시트는 실크 단백질 기반 소재의 기계적 물성에 크게 영향을 미치는 요인으로 알려져 있다(27). 베타 시트는 (GAGAGS)라는 실크 아미노산의 조합과 (GAGAGY)조합으로 이루어져 있다. 구체적으로, 베타 시트를 이루는 아미노산인 글리신(G), 알라닌(A), 세린(S), 그리고 티로신(Y)의 아민 그룹과 카르복실 그룹 사이의 서로 수소 결합을 하여 강하게 결합되고, 베타 시트를 구성하는 아미노산은 아미노산끼리 강하게 결합하는 소수성 작용 및 반데르발스 작용으로 강하게 결합되어 있는 것으로 알려져 있다(24,25). 이와 반대로, (GAAS) 아미노산 조합로 되어있는 부분은 친수성 작용이 강하기 때문에 턴 및 코일 형태의 2차 구조를 형성하고 접힘 현상이 있는 것을 발견할 수 있다. 이는 이전 연구에서 보고된 경향과 일치한다(13). (Fig. 1 참조) 이에 대해 정량적인 결과 분석을 통해서도 알 수 있는데, Fig. 2(a)는 분자 동역학 시뮬레이션 동안의 구조의 유사성을 RMSD 값으로 분석한 결과이다. 그 결과, 실크 단백질의 RMSD 값은 매우 안정되어 있는 것을 확인할 수 있다. 또한, Fig. 2(b)는 실크 단백질에서 결정질의 2차 구조의 비율을 분석한 결과이다. 이를 보면 실크 단백질의 기계적 물성과 매우 관련이 높은 베타 시트 비율이 약 60 %로 매우 높은 것을 확인할 수 있다. 또한 (GAAS) 아미노산 조합로 인한 코일 및 턴의 2차 구조도 형성되어 있는 것을 확인할 수 있다. 이러한 이유는 (GAGAGS) 아미노산 조합 및 (GAGAGY) 아미노산 조합이 수소 결합을 통해 연결되어 있기 때문이다. 이 때의 수소 결합의 수는 평균적으로 1082.2개인 것으로 분석되었다(Fig. 2(c) 참조). 따라서, 실크 단백질의 베타 시트는 (GAGAGS) 아미노산 조합 및 (GAGAGY) 아미노산 조합의 수소 결합에 의해서 강하게 결합하여 형성될 수 있음을 알 수 있으며, 수소 결합의 수가 많을수록 실크 단백질의 기계적 물성에 영향을 미치는 중요한 요소인 것을 확인할 수 있다.
3.2 실크 단백질 기반 나노 소재의 물성 분석
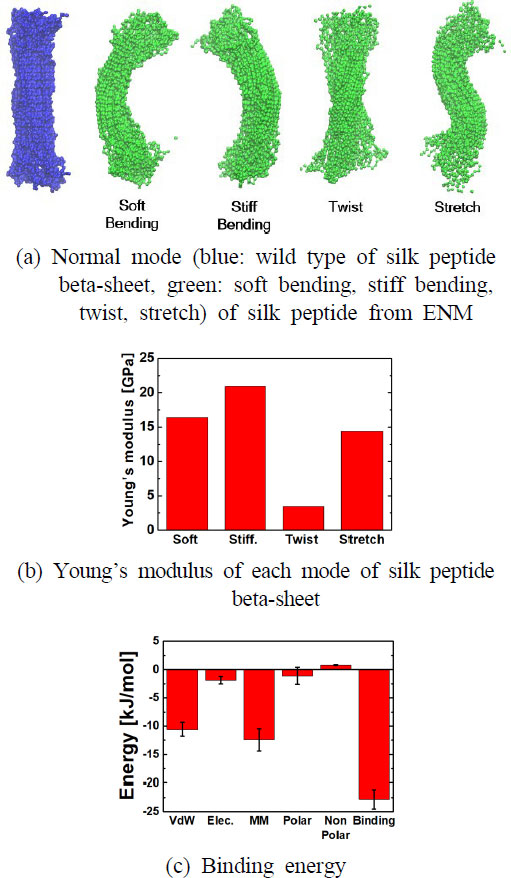
실크 단백질 기반 나노 소재의 성능을 고찰하기 위해서 탄성 네트워크 모델 및 고유 모드 해석을 이용하여 기계적 물성을 분석하였다. 이를 기반으로 실크 기반 나노 소재의 기계적 특성을 측정하였다. 여기서 강체 운동에 대한 진동 모드는 제외하고, 최저 주파수(7-12 th)는 ~ 0.1 THz이고 해당 진동 모드는 실크 기반 나노 소재의 진동 거동과 유사한 굽힘 모드이다. 단면적의 이방성으로 인해 두 가지 기본적인 굽힘 모드를 각각 soft. 굽힘 모드와 stiff. 굽힘 모드를 고려하였습니다. 각 고유 진동수에 따른 모드는 Fig. 3(a) 및 Table 1으로 정리하였다. 이에 대해 각 모드에 대해 영률은 다음과 같다. Soft. 굽힘(16.419 GPa), stiff. 굽힘(20.904 GPa), 비틀림(3.461 GPa), 그리고 인장(14.376 GPa)이다. 특히, soft. 굽힘 및 stiff. 굽힘에 대한 탄성계수가 비틀림 및 인장의 탄성계수가 높은 것을 알 수 있는데, 이는 실크 기반 나노 소재에 대한 우세한 변형이 굽힘 변형임을 의미한다. 기존 연구에 따르면 누에 실크에 대한 영률은 약 5 GPa ~ 25 GPa로 알려져 있는데(26), 이러한 경향과 매우 잘 맞는 것을 확인할 수 있다. 이렇게 우수한 기계적 물성의 원인은 실크 단백질의 결정질 중에서 베타 시트 형성 비율과 수소결합이 높아짐에 따라 더 강화되는 것을 알 수 있다(27). 이에 대한 이유는 베타 시트 형성의 중요한 원인은 수소 결합, 소수성 효과, 반데르발스 결합으로 알려져 있는데 베타 시트 구조는 이를 통해서 구조적으로 강하게 결합한 상태로 존재하기 때문이다(13). 소수성 효과 및 반데르발스 결합을 추가적으로 분석하였는데, Fig. 3(c)에서 반데르발스 에너지는 약 -11.412 kJ/mol, 소수성 효과와 연관되는 분자 기계적 에너지(-13.512 kJ/mol) 및 Polar 에너지(-3.662 kJ/mol)인 것을 확인할 수 있다. 이러한 정량적 결과는 베타 시트가 반데르발스 결합 및 소수성 효과로 결합되어 있는 것을 시사한다. 최종적으로 결합 에너지는 -22.337 kJ/mol로써, 베타 시트의 우수한 기계적 물성의 원인은 반데르발스 결합 및 polar, 분자 기계적 에너지를 통해 확인하였다. 따라서, 실크 단백질 기반 나노 소재의 기계적 물성에 미치는 중요한 요인은 반데르발스 결합과 소수성 작용인 것을 추가적으로 알 수 있다.
4. 결 론
우수한 물성을 가진 실크 단백질 기반 나노 소재에 대해 미세 구조 및 기계적 물성의 연관성을 분석하기 위해 분자동역학과 탄성네트워크 모델 및 모드 해석을 이용하여 원인 및 중요 인자를 분석하였다. 실크 단백질 기반 나노 소재에 대한 높은 기계적 물성은 실크 단백질을 이루는 베타 시트의 수소 결합, 소수성 작용, 그리고 반데르발스 작용이다. 특히, 약 1082개의 높은 수소 결합과 약 60 %의 높은 베타 시트 함유율은 실크 단백질 기반 나노 소재의 기계적 물성을 높이는 결과인 것을 확인하였다. 또한, 우리는 실크 단백질 기반 나노 소재의 구조와 기계적 물성의 연관성을 고찰하기 위해 탄성 네트워크 모델 및 모드 해석을 통해 기계적 물성을 분석하였고, 이에 대한 요인을 에너지 계산을 통해 고찰하였다. 각 모드 형상에 대해 평균 13.789 GPa 우수한 영률을 달성하는 것을 확인할 수 있었으며, 이에 대한 이유는 반데르발스 및 소수성 작용에 기인하는 것을 재확인하였다. 따라서, 실크 단백질 기반 나노 소재를 설계하는데 있어서 실크의 베타시트 구조가 중요한 요인이며, 이에 기인한 수소 결합, 반데르발스 및 소수성 작용을 고려해야하는 것을 제시한다. 이를 통해 우수한 기계적 물성을 달성하는 것을 확인하였으며, 감광 소재 등 여러 분야에서 신소재 후보로써 실크 단백질은 매우 중요한 차세대 후보임을 입증하였다.
Acknowledgments
이 논문은 2022년도 정부의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(2022R1A2B5B01001-928), Funding: This work was supported by an NRF (National Research Foundation of Korea) grant funded by the Korean Government (NRF-2018-Fostering Core Leaders of the Futrue Basic Science Program/Global PhD Fellowship Program) (No.2018H1A2A1062291).
References
-
Zhou, L., Fu, P., Cai, X., Zhou, S. and Yuan, Y., 2016, Naturally Derived Carbon Nanofibers as Sustainable Electrocatalysts for Microbial Energy Harvesting: A New Application of Spider Silk, Applied Catalysis B: Environmental, Vol. 188, pp. 31~38.
[https://doi.org/10.1016/j.apcatb.2016.01.063]

-
Kiseleva, A. P., Krivoshapkin, P. V. and Krivoshapkina, E. F., 2020, Recent Advances in Development of Functional Spider Silk-based Hybrid materials, Frontiers in Chemistry, Vol. 8, pp. 554.
[https://doi.org/10.3389/fchem.2020.00554]

-
Fahnestock, S. R. and Irwin, S. L., 1997, Synthetic Spider Dragline Silk Proteins and Their Production in Escherichia Coil, Applied Microbiology and Biotechnology, Vol. 47, No. 1, pp. 23~32.
[https://doi.org/10.1007/s002530050883]

-
Yamane, T., Umemura, K., Nakazawa, Y. and Asakur, T., 2003, Molecular Dynamics Simulation of Conformational Change of Poly(Ala-Gly) from Silk I to Silk II in Relation to Fiber Formation Mechanism of Bombyx Mori Silk Fibroin, Macromolecules, Vol. 36, No. 18, 6766~6772.
[https://doi.org/10.1021/ma034466o]

-
Qiao, X., Qian, Z., Li, J., Sun, H., Han, Y., Xia, X., Zhou, J., Wang, C., Wang, Y. and Wang, C., 2017, Synthetic Engineering of Spider Silk Fiber as Implantable Optical Waveguides for Low-loss Light Guiding, ACS Applied Materials & Interfaces, Vol. 9, No. 17, pp. 14665~14676.
[https://doi.org/10.1021/acsami.7b01752]

-
Kujala, S., Maannia, A., Karvonen, L., Kieu, K. and Sun, Z., 2016, Natural Silk as a Photonics Component: A Study on Its Light Guiding and Nonlinear Optical Properties, Scientific Reports, Vol. 6, No. 1, pp. 1~9.
[https://doi.org/10.1038/srep22358]

-
Porter, D. and Vollrath, F., 2009, Silk as a Biomimetic Ideal for Structural Polymers, Advanced Materials, Vol. 21, No. 4, pp. 487~492.
[https://doi.org/10.1002/adma.200801332]

-
Wang, H. Y., Wei, Z. G. and Zhang, Y. Q., 2020, Dissolution and Regeneration of Silk from Silkworm Bombyx Mori in Ionic Liquids and Its Application to Medical Biomaterials, International Journal of Biological Macromolecules, Vol. 143, pp. 594~601.
[https://doi.org/10.1016/j.ijbiomac.2019.12.066]

-
Huang, W., Ling, S., Li, C., Omenetto, F. G. and Kaplan, D. L., 2018, Silkworm Silk-based Materials and Devices Generated using Bio-nanotechnology, Chemical Society Reviews, Vol. 47, No. 17, pp. 6486~6504.
[https://doi.org/10.1039/C8CS00187A]

-
Lin. H., Xu, S., Zhang, Y. Q. and Wang, X., 2014, Electron Transport and Bulk-like Behavior of Wiedmann-Franz Law for Sub-7nm-thin Lridium Films on Silkworm Silk, ACS Applied Materials & Interfaces, Vol. 6, No. 14, pp. 11341~11347.
[https://doi.org/10.1021/am501876d]

-
Kurland, N. E., Dey, T., Kundu, S. C. and Yadavalli, V. K., 2013. Precise Patterning of Silk Microstructures using Photolithography, Advanced Materials, Vol. 25, No. 43, pp. 6207~6212.
[https://doi.org/10.1002/adma.201302823]

-
Belshaw, L., Calegari, F., Duffy, M. J., Trabattoni, A., Poletto, L., Nisoli, M., & Greenwood, J. B., 2012, Observation of Ultrafast Charge Migration in an Amino Acid, Journal of Physics Chemistry Letter, Vol. 3, pp. 3751~3754.
[https://doi.org/10.1021/jz3016028]

-
Qiu, W., Patil, A., Hu, F. and Liu, X. Y., 2019, Hierarchical Structure of Silk Materials Versus Mechanical Performance and Mesoscopic Engineering Principles, Small, Vol. 15, No. 51, p. 1903948.
[https://doi.org/10.1002/smll.201903948]

-
Asakura, T., Okushita, K. and Williamson, M. P., 2015, Analysis of the Structure of Bombyx Mori Silk Fibroin by NMR, Macromolecules, Vol. 48, No. 8, pp. 2345~2357.
[https://doi.org/10.1021/acs.macromol.5b00160]

-
Lindorff-Larsen, K., Piana, S., Palmo, K., Maragakis, P., Klepeis, J. L., Dror, R. O. and Shaw, D. E., 2010, Improved Side-chain Torsion Potentials for the Amber ff99SB Protein Force Field, Proteins: Structure, Function, and Bioinformatics, Vol. 78, No. 8, pp. 1950~1958.
[https://doi.org/10.1002/prot.22711]

-
Xiao, S., Stacklies, W., Cetinkaya, M., Markert, B. and Gräter, F., 2009, Mechanical Response of Silk Crystalline Units from Force-distribution Analysis, Biophysical Journal, Vol. 96, No. 10, pp. 3997~4005.
[https://doi.org/10.1016/j.bpj.2009.02.052]

-
Wongpinyochit, T., Vassileiou, A. D., Gupta, S., Mushrif, S. H., Johnston, B. F. and Seib, F. P., 2019, Unraveling the Impact of High-order Silk Structures on Molecular Drug Binding and Release Behaviors, Journal of Physics Chemimstry Letter, Vol. 10, No. 15, pp. 4278~4284.
[https://doi.org/10.1021/acs.jpclett.9b01591]

-
Atilgan, A. R., Durell, S. R., Jernigan, R. L., Demirel, M. C., Keskin, O. and Bahar, I., 2001, Anisotropy of Fluctuation Dynamics of Proteins with an Elastic Network Model, Biophysical Journal, Vol. 80, pp. 505~515.
[https://doi.org/10.1016/S0006-3495(01)76033-X]

-
Yoon, G., Kab Kim, Y., Eom, K. and Na, S., 2013, Relationship between Disease-specific Structures of Amyloid Fibrils and Their Mechanical Properties, Applied Physics Letters, Vol. 102, pp. 011914.
[https://doi.org/10.1063/1.4774296]

-
Yoon, G., Kwak, J., Kim, J. I., Na, S. and Eom, K., 2011, Mechanical Characterization of Amyloid Fibrils Using Coarse-grained Normal Mode Analysis, Advanced Functional Materials, Vol. 21, No. 18, pp. 3454~3463.
[https://doi.org/10.1002/adfm.201002493]

- Conway, H. D. 1980, Formulas for Natural Frequency and Mode Shape, by Robert D. Blevins, Journal of the Acoustical Society of America, Vol. 67, p. 1849.
-
Kumari, R., Kumar, R., Open Source Drug Discovery Consortium and Lynn, A., 2014, g_mmpbsa-A GROMACS Tool for High-throughput MM-PBSA Calculations, Journal of Chemical Information and Modeling, Vol. 54, No. 7, pp. 1951~1962.
[https://doi.org/10.1021/ci500020m]

-
Wang, E., Sun, H., Wang, J., Wang, Z., Liu, H., Zhang, J. Z. and Hou, T., 2019, End-point Binding Free Energy Calculation with MM/PBSA and MM/GBSA: Strategies and Applications in Drug Design, Chemical Reviews, Vol. 119, No. 16, pp. 9478~9508.
[https://doi.org/10.1021/acs.chemrev.9b00055]

-
Humphrey, W., Dalke, A. and Schulten, K., 1996, VMD: Visual Molecular Dynamics, Journal of Molecular Graphics, Vol. 14, No. 1, pp. 33~38.
[https://doi.org/10.1016/0263-7855(96)00018-5]

-
Asakura, T., 2021, Structure of Silk I (Bombyx Mori Silk Fibroin before Spinning): Type II β-Turn, Not α-Helix, Molecules, Vol. 26, pp. 3706.
[https://doi.org/10.3390/molecules26123706]

-
Keten, S., Xu, Z., Ihle, B. and Buehler, M. J., 2010, Nanoconfinement Controls Stiffness, Strength and Mechanical Toughness of β-sheet Crystals in Silk, Nature Materials, Vol. 9, pp. 359~367.
[https://doi.org/10.1038/nmat2704]

-
Guo, C., Zhang, J., Jordan, J. S., Wang, X., Henning, R. W. and Yarger, J. L., 2018, Structural Comparison of Various Silkworm Silks: An Insight into the Structure-property Relationship, Biomacromolecules, Vol. 19, No. 3, pp. 906~917.
[https://doi.org/10.1021/acs.biomac.7b01687]


Wooboum Park is from Republic of Korea. After graduating from Korea University, he obtained combined doctorate course form Korea University in school of engineering science and mechanics. His research interests are in computational mechanics, molecular dynamics and Silk-peptide based materials with electrochemical experiments.

Sungsoo Na is a professor in the Department of Engineering Science and Mechanics at Korea University. He received B.S. and M.S. in engineering science and mechanics at Korea University and received Ph.D. in engineering science and mechanics at Virginia Polytechnic Institute & State University. His principle research interests include detection of toxic nanomaterial and protein dynamics.